SCIENZE
La scienza non è un insieme di asserzioni certe, o stabilite una volta per tutte, e non è neppure un sistema che avanzi costantemente verso uno stato definitivo. La nostra scienza non è conoscenza: non può mai pretendere di aver raggiunto la verità, e neppure un sostituto della verità come la probabilità.
(Karl Popper, Logica della scoperta scientifica, 1959)
L'ATOMO
Inserisci sottotitolo qui

L'atomo è una struttura nella quale è normalmente organizzata la materia nel mondo fisico o in natura. Più atomi formano le molecole, mentre gli atomi sono a loro volta formati da costituenti subatomici quali i protoni (con carica positiva), neutroni (con carica neutra) ed elettroni (con carica negativa). Era così chiamato perché inizialmente era considerato l'unità più piccola ed indivisibile della materia. Verso la fine dell'Ottocento (con la scoperta dell'elettrone) fu dimostrato che l'atomo era in realtà divisibile, essendo a sua volta composto da particelle più piccole, alle quali ci si riferisce con il termine di particelle subatomiche.
TEORIE ATOMICHE
Nel 1803, John Dalton per primo cercò di descrivere l'atomo e lo fece basandosi su due delle tre leggi fondamentali della chimica Dalton, per creare il suo modello atomico, si baserà su dei punti fissi; ognuno di essi sarà in accordo con le due leggi fondamentali. In particolare, i primi tre punti implicano che in una reazione chimica gli atomi rimangono invariati in numero e in massa e ciò è in accordo con la legge di conservazione della massa di Lavoisier, mentre il punto quattro è in accordo con la legge delle proporzioni definite di Proust.
Teoria di Dalton:
1. Tutta la materia è formata da particelle microscopiche indistruttibili e indivisibili chiamate atomi.
2. Tutti gli atomi di uno stesso elemento sono tutti uguali tra loro per dimensione, forma e massa e proprietà.
3. Gli atomi di elementi diversi hanno masse diverse.
4. Le reazioni chimiche consistono nella separazione e ricombinazione di atomi.
5. Nessun atomo di un elemento si trasforma nell'atomo di un altro elemento.
Teoria di Rutherford:
successivamente si scoprì che questa teoria era errata, infatti l'analisi compiuta da Rutherford nel 1911 suggerì che il modello atomico a panettone di J. J. Thomson non fosse corretto. Il nuovo modello proposto da Rutherford aveva delle caratteristiche che sono rimaste anche in modelli successivi come la concentrazione della maggioranza della materia in un volume relativamente piccolo rispetto alle dimensioni atomiche e la presenza di elettroni rotanti intorno ad esso, come i pianeti del sistema solare attorno al sole. L'atomo dunque, secondo questo modello, sarebbe in gran parte vuoto. Rutherford introduce inoltre il concetto di peso atomico che era stato tralasciato dal predecessore Thomson nel modello a panettone, annettendo l'esistenza di un nuovo tipo di particella nella composizione del nucleo interno: i neutroni, fondamentali ai fini di una corretta determinazione del peso atomico.Gli orbitali elettronici dell'atomo non influenzano lo scattering delle particelle alfa. La maggior parte della carica atomica - espressa in unità della carica dell'elettrone (la carica fondamentale) - fino al più ad un numero uguale alla metà della massa dell'atomo - espressa in unità di massa atomica (si usava la massa dell'atomo di idrogeno come unità) - è concentrata in un volume molto piccolo -rispetto al volume dell'intero atomo - al centro dello stesso. Questa carica è responsabile dello scattering Rutherford. La massa di atomi pesanti è concentrata nella regione centrale dove risiede anche la carica, dato che i calcoli non mostrano che sia spostata o deflessa da particelle alfa ad alta velocità che girano intorno al nucleo su cerchi, dette orbite. Da qui sono stati scoperti due numeri molto importanti Ii numero atomico(indicato solitamente con Z, dal termine tedesco Zahl, che significa numero, e detto anche numero protonico) corrisponde al numero di protonicontenuti in un nucleo atomico. In un atomo neutro il numero atomico è pari anche al numero di elettroni; in caso contrario si è in presenza di uno ione. Si usa scrivere questo numero come pedice sinistro del simbolo dell'elemento chimico in questione: per esempio 6C, poiché il carbonio ha sei protoni. Il numero di massa (solitamente indicato con A) è pari al numero di nucleoni (cioè protoni e neutroni) presenti in un atomo.Quando di un elemento si vuole specificare il numero di massa, lo si scrive in alto (in posizione apice), a sinistra del simbolo chimico. Ad esempio, per l'atomo del carbonio, con numero di massa 12 si rappresenta la somma dei suoi 6 protoni e dei rispettivi neutroni: 12C. Nel 1913 Niels Bohr propose il modello atomico, ampliato da Arnold Sommerfeld nel 1916, è la più famosa applicazione della quantizzazione dell'energia, che, insieme all'equazione di Schrödinger e alle spiegazioni teoriche sulla radiazione di corpo nero, sull'effetto fotoelettrico e sullo scattering Compton sono la base della meccanica quantistica.
POSTULATI:
1. Gli elettroni si muovono su traiettorie circolari (orbite) ed hanno specifici valori di energia (quanti).
2. Si emette luce quando l'elettrone si muove da un livello di energia più alto e più basso. En= - Rh ( 1 / n^2)
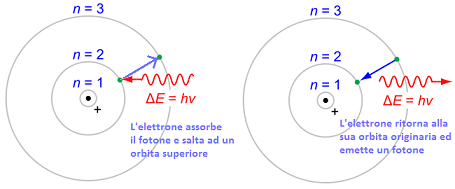
Fu poi formulata dal fisico tedesco Max Planck la legge di Planck, la quale afferma che l'energia associata a una radiazione elettromagnetica è trasmessa in pacchetti discreti chiamati quanti, ciascuno dei quali è associato a un singolo fotone.
La dimensione E di un quanto di energia dipende dalla frequenza ν della radiazione secondo la formula: E= hv
Prorietà delle onde
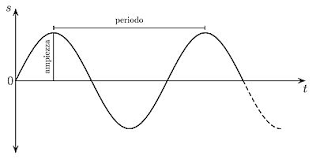
Lunghezza d'onda(wavelunght -λ) è la distanza fra due punti identici succesivi.
Ampiezza d'onda(amplitude) è la distanza dal centro dell'onda al momento del picco.
Frequenza(v)è il numero di lunghezza d'onda che passano per un particolare punto in 1 secondo
La velocità dell'onda(m/s)=1
Equazione di Schrodinger
il movimento degli elettroni avviene in tre dimensioni per cui le soluzioni accettabili dell'equazione d'onda deriva dalla combinazione di tre costanti dette Numeri quantici ed indicati con le lettere:n,l,m. Ogni funzione d'onda caraterizzata da tre numeri quantici Ψnlm viene chiamata orbitale e corrisponde ad uno stato stazionario possibile per l'elettrone.
Orbitale atomico→Ψ= F(n,l,m) numero quantico principale n n=1,2,3,4.....
Numero quantico secondario o angolare: l=0,1,2,3 (n-1) n=1 l=0 l=0 orbitale s n=2 l=0,1 l=1 // p n=3 l=0,1,2 l=2 // d l=3 // f Forma del "volume" di spazio occupato da C¯ numero quantico magnetico ml ml=-l......,0,......+l l=0(orbitali s) ml=o l=1( // p) ml=-1,0,1 l=2( // d) ml=-2,-1,0,1,2 Esiste un quarto numero quantico: ms (rotazione attorno all'asse) (ms= ± 1/2) lettera s p d f g 0 1 2 3 4 orbitale s= forma sferica // p=forma otto o clessidra // d=forma quadrifoglio
Configurazione elettronica
Regole dell'Aufbau
- un orbitale può contenere un numero massimo di 2 elettroni con spin opposto. L'orbitale può anche essere vuoto o contenerne uno solo(spaiato).
- nel progressivo riempimento degli orbitali l'elettrone va ad occupare l'orbitale disponibile avente più basso energia.
- se vi sono orbitali con uguale energia la configurazione più stabile è quella che porta alla massima molteplicità, cioè in cui gli elettroni si dispongono con spin parallelo e quindi in orbitali diversi.
L'atomo di carbonio
Il carbonio è l'elemento chimico della tavola periodica degli elementi che ha come simbolo C e come numero atomico 6. È un elemento non metallico, tetravalente (e raramente bivalente), insolubile nei solventi, inodore e insapore.
L'elemento chimico carbonio ha numero atomico 6 (Z = 6) e massa atomica relativa
12,011.
I suoi elettroni tendono a riempire progressivamente gli orbitali atomici, partendo dai
sottolivelli dei livelli interni, più poveri di energia.
Il primo livello energetico, che coincide anche con il suo sottolivello, presenta un solo
orbitale di forma sferica (1s) al cui interno possono stare al massimo due elettroni con
spin opposto o antiparallelo.
Il secondo livello energetico è suddiviso in due sottolivelli:
a) il più povero di energia è il sottolivello 2s, con un solo orbitale di forma sferica che
ha il raggio maggiore rispetto a quello dell'orbitale 1s; l'orbitale 2s può contenere al
massimo due elettroni, purché dotati di spin opposto;
b) il sottolivello 2p è costituito invece da tre orbitali a forma di doppia pera contrapposta
(2 lobi), con l'asse di maggiore allungamento coincidente con uno degli assi cartesiani
dello spazio (x, y, z). Il secondo sottolivello può contenere al massimo sei elettroni
(cioè due per ogni orbitale).
Il secondo livello energetico può quindi contenere un massimo di otto elettroni.
Fornendo ancora energia (E3) all'atomo di carbonio sp2
, viene ad essere interessato anche
uno degli orbitali 2p che conteneva un singoletto elettronico.
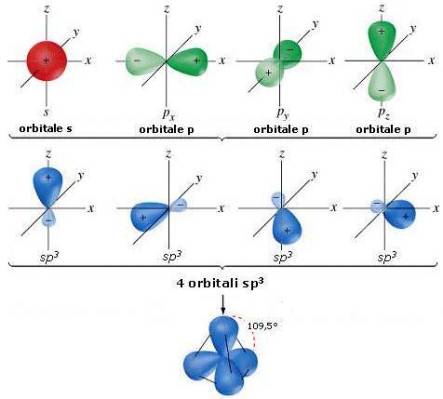
Si vengono a formare quattro orbitali ibridi sp3
, a forma di mazza da baseball, ognuno
dei quali contiene un elettrone.
Nei quattro orbitali ibridi sp3
i singoletti elettronici si dispongono uno per orbitale e con
spin uguali, paralleli.
Avere degli orbitali ibridi sp3
significa che alla loro formazione hanno contribuito un
orbitale s (il 2s) e tre orbitali p (l'orbitale 2p vuoto e tutti e due gli orbitali 2p1
con il
singoletto elettronico).
Tipi di legame che si formano tra due atomi di carbonio
Se sono interessati due orbitali ibridi, che si sovrappongono secondo il loro asse di
maggiore allungamento, si ottiene un legame di tipo σ (sigma), legame che si forma per
primo e si distrugge per ultimo.
Se sono interessati due orbitali non ibridi di tipo 2p1
, in compenetrazione parallela, si
ottiene un legame di tipo π, che si forma dopo il legame di tipo σ e si distrugge prima
di quest'ultimo. I quattro orbitali ibridati sp3
sono asimmetrici e quindi la distribuzione più simmetrica
dei loro volumi si ottiene se, rispetto al nucleo, noi li disponiamo non più sul piano, ma
nello spazio, con gli assi di maggiore allungamento disposti reciprocamente a 109° 28',
come nei cavalli di Frisia (sbarramenti militari contro le incursioni dei carri armati nemici):
possiamo definire questi assi con dei simboli di comodo (ad esempio: a, b, c, d).
Queste direzioni corrispondono infatti a quelle che, in un tetraedro regolare, congiungono
il baricentro con i quattro vertici. E' da ricordare che la minima figura poliedrica regolare
e chiusa nello spazio è proprio quella del tetraedro regolare.
Inoltre questo solido ha un'altra interessante proprietà: tutte e quattro le sue facce sono
dei triangoli equilateri, cioè delle figure poligonali chiuse che nel piano presentano la
massima simmetria con il minor numero di lati possibili. Se si hanno due atomi di carbonio adiacenti che sono ibridati sp2
, tra di essi si forma un
doppio legame:
3) per primo si forma un legame di tipo σ, dovuto alla sovrapposizione massima e collineare
dei due orbitali ibridati sp che, contrapposti (appartengono a due atomi diversi)
si avvicinano nello spazio da destra e da sinistra lungo la direzione (per esempio)
dell'asse y.
4) Si forma quindi un legame di tipo π, dovuto alla compenetrazione parallela degli
orbitali 2p1
che, nei due atomi di carbonio, sono orientati secondo la direzione z.
Ognuno dei due atomi di carbonio ha poi la possibilità di formare, alla sua destra o alla
sua sinistra e nel piano, altri due legami di tipo σ verso altri atomi di carbonio distinti,
contribuendo ad allungare la catena di atomi di carbonio zigzagando sul piano e, al limite,
la catena può chiudersi ad anello su se stessa (in genere ciò può avvenire facilmente
con 5 o 6 atomi di carbonio ibridati sp2
).
Nella posizione del doppio legame non è permessa la rotazione molecolare.
